Antes de tudo é preciso ter certeza de que você não está mesmo grávida. Se o exame de sangue deu negativo (com hCG abaixo de 5 IU/l, por exemplo), é negativo mesmo. Já o exame de urina pode dar falso negativo, se for feito muito cedo. Para ter certeza, repita o exame depois de mais alguns dias. Caso dê negativo de novo, é provável que o atraso da menstruação tenha outra razão.
A menstruação pode atrasar devido a uma série de motivos, incluindo estresse e atividades físicas exageradas.
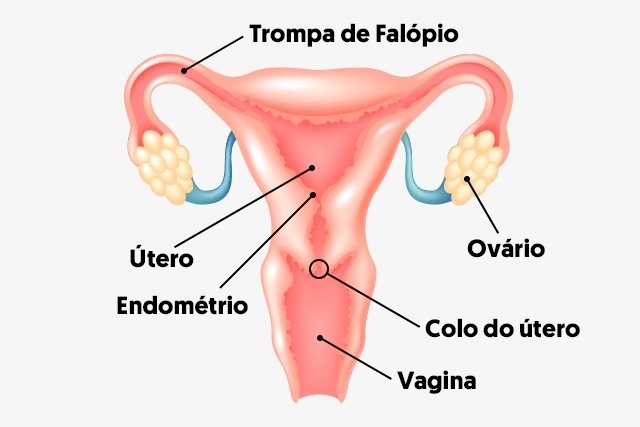
Em um ciclo menstrual regular, um dos ovários geralmente libera um óvulo a cada, mais ou menos, 28 dias e, se depois de 14 não houver a fertilização, a parede interna do útero "descama" e a menstruação se inicia.
Se os ovários não liberam óvulos conforme deveriam, é possível que o útero não receba todos os sinais de que precisa para deflagrar a menstruação. Dependendo do histórico, podem ser receitados medicamentos para ajudar os ovários e o útero a se comunicar e a menstruação acontecer com regularidade.
Caso mais de três menstruações não tenham vindo e os testes de gravidez continuem negativos, procure um médico para passar por uma avaliação e descobrir o que anda causando a irregularidade menstrual. Entre as possibilidades estão:
• Problemas de tiroide: Se a sua tiroide (glândula que controla o metabolismo do corpo) não estiver funcionando direito, poderá haver efeitos na menstruação e na ovulação. Entre os sintomas de problemas de tiroide estão cansaço extremo, perda de cabelo, ganho de peso e uma sensação constante de frio, mesmo quando todos ao redor parecem confortáveis com a temperatura.
Um simples exame de sangue pode determinar como anda o funcionamento da tiroide e evitar que ela desregule ainda mais seu corpo. Desequilíbrios de tiróide são corrigidos com remédios.
• Excesso de prolactina: Quando o cérebro produz um nível bem acima do normal do hormônio prolactina, a menstruação pode começar a falhar. O corpo feminino costuma fabricar prolactina para amamentar, razão pela qual a menstruação geralmente fica interrompida quando uma mulher dá de mamar.
Se você não está amamentando (ou grávida), mas notou um corrimento esbranquiçado saindo dos mamilos, então pode mesmo haver um problema de prolactina no seu organismo. Isso também pode ser medido através de exames de sangue e depois tratado com medicação.
Fonte: Baby Center Brasil